illusztrálása
2. ábra. "Mikroállapotok"
LISZI JÁNOS
Kvantumok a kémiában
Statisztikus mechanika
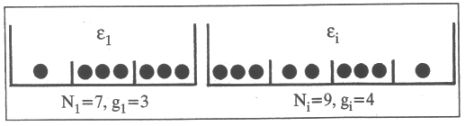
A "statisztikus mechanika" kifejezést először Gibbs használta egy 1902-ben megjelent könyvében. (A statisztikus mechanika helyett gyakran használják a statisztikus termodinamika elnevezést is.) A dolog azonban korábban kezdődött, Boltzmann 1868-ban és 1871-ben megjelent közleményeivel. Ezekben azt vizsgálta, hogyan oszlik el az energia a rendszert alkotó részecskék között. A valóságos anyagban nagyon sok részecske van (pl. 18 g vízben 6ˇ1023 db), ezért csak azt tudjuk vizsgálni, hogy a részecskék közül mennyinek van valamilyen adott nagyságú energiája. Legyen V térfogatban N részecske és legyen a rendszernek U energiája; ε1 energiája van N1 számú részecskének, ε2 energiája van N2-nek, ... , εi energiája van Ni-nek stb. Látjuk tehát, hogy Boltzmann diszkrét energiaszinteket feltételezett, jóllehet nem használta a kvantum kifejezést. A kvantumelmélet Boltzmannal kezdődött. Természetesen ΣNi=N. N1, N2, ..., Ni , ... jelentik a betöltési számokat. A betöltési számok ismeretében a rendszer minden tulajdonságát ki tudjuk számolni. Például a belső energia: U=ΣNiεi. Boltzmann levezette, hogy az i-edik energiaszinten levő részecskék száma: Ni=(N/z)exp[-εi/kT], ahol k-t ma Boltzmann-állandónak nevezzük és T a hőmérséklet. Az exp[-εi/kT] kifejezés neve: Boltzmann-faktor. A nevezőben szereplő z az állapotösszeg (a német Zustandsumméből fordítva ) és z=Σexp[-εi/kT]. Az állapotösszeg ismeretében a rendszer minden termodinamikai tulajdonsága kiszámítható. Boltzmann bécsi sírkövére egy másik híres egyenlete van fölvésve: S=klnW. S természetesen itt is entrópiát jelent, de mit jelent W? Ennek megértéséhez finomítanunk kell a fenti képet. Szemléltessük az energiaszinteket dobozokkal, a részecskéket golyókkal. A kérdéses szinten levő részecskék száma a betöltési szám. A részecske többféle állapota tartozhat egyazon energiához, azt mondjuk, hogy az energiaszintek degeneráltak. A degenerált állapotokat a dobozban levő rekeszek képviselik, ezek száma g1, g2, ... gi .... Példaként az 1. ábra mutat két energiaszintet ebben a reprezentációban.
 | 1. ábra. Két degenerált
állapot illusztrálása 2. ábra. "Mikroállapotok" |
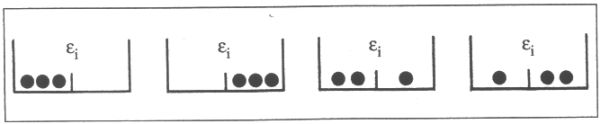
Az N1, N2, ... Ni betöltési számok egy sorozatát a rendszer egy makroállapotának nevezzük. Ez megváltozik, ha egyik dobozból részecskét viszünk át egy másik dobozba. Nem változik viszont, ha egy-egy dobozon belül, a rekeszek között változtatjuk a részecskék számát. Az utóbbi változtatásokkal létrejövő új helyzetet egy makroállapothoz tartozó új mikroállapotnak nevezzük. A mikroállapotok azonos energiaeloszlást valósítanak meg, egymás között mégis megkülönböztethetőek. W azoknak a mikroállapotoknak a számát jelenti, amelyekkel egy makroállapot megvalósulhat. Ezt szemlélteti egyszerű példával a 2. ábra. Ni=3, gi=2. Ebben az esetben Wi=4.
Az a legvalószínűbb energiaeloszlás, amely a legtöbb mikroállapottal valósítható meg; erre W maximális. Ott van W maximuma, ahol a szintek közötti rendezetlenség a legnagyobb, ott van ugyanis a legtöbb mikroállapot kialakulására mód. Ezért mondjuk, hogy az entrópia a rendezetlenség mértéke. Ha két különböző folyadékot összeöntünk, akkor a létrejövő elegy rendezetlenebb állapotot jelent, mint amikor még külön-külön edényben vannak a folyadékok. Az elegyhez nagyobb entrópia tartozik, mint a tiszta folyadékokhoz, elegyedés során növekszik az entrópia.
Ludwig Boltzmann (1844-1906)
 Bécsben született. A bécsi egyetemen tanult, ahol többek között Josef Stefan és Josef Loschmidt volt a tanára. Első jelentős közleményét 1866-ban írta, 22 évesen, egy évvel a doktorátus megszerzése előtt. Ennek címe: "A termodinamika második főtételének mechanikai értelmezése." Ugyanebben a témában 1870-ben és 1871-ben Clausius közölt dolgozatokat, újra felfedezve Boltzmann gondolatait. Boltzmann reakciója egy válaszcikk volt, amelyet így fejezett be: "Csak örömömet tudom kifejezni, hogy egy olyan nagy tekintélyű személyiség, mint Clausius úr népszerűsíti termodinamikai eredményeimet." Maxwell figyelte ezt a prioritási vitát, és ezt írta barátjának, Taitnek: "Ritka jó sport nézni, ahogyan ezek a tanult németek arról vitatkoznak ki jött rá előbb arra, hogy a termodinamika második főtétele a Hamilton-elv."
Bécsben született. A bécsi egyetemen tanult, ahol többek között Josef Stefan és Josef Loschmidt volt a tanára. Első jelentős közleményét 1866-ban írta, 22 évesen, egy évvel a doktorátus megszerzése előtt. Ennek címe: "A termodinamika második főtételének mechanikai értelmezése." Ugyanebben a témában 1870-ben és 1871-ben Clausius közölt dolgozatokat, újra felfedezve Boltzmann gondolatait. Boltzmann reakciója egy válaszcikk volt, amelyet így fejezett be: "Csak örömömet tudom kifejezni, hogy egy olyan nagy tekintélyű személyiség, mint Clausius úr népszerűsíti termodinamikai eredményeimet." Maxwell figyelte ezt a prioritási vitát, és ezt írta barátjának, Taitnek: "Ritka jó sport nézni, ahogyan ezek a tanult németek arról vitatkoznak ki jött rá előbb arra, hogy a termodinamika második főtétele a Hamilton-elv."
Boltzmann nehezen találta meg a helyét, gyakran változtatott állást. Először Grazban tanított, majd Bécsben, majd ismét Grazban. További állomások: München, Bécs, Lipcse, Bécs.
Boltzmann munkáit erős támadások érték, elsősorban Ernst Mach és Wilhelm Ostwald részéről, akik nem hittek az atomok valóságos létezésében és a statisztikus tárgyalásmódot csak hipotézisnek tekintették. Boltzmannt ez mélységesen elkeserítette. Úgy érezte, hogy "kontinentális" kollégái nem támogatják, csak Angliában kap elismerést. Elkeseredése tragikus véghez vezetett. 1906-ban a Trieszt melletti Duinóban, miközben felesége és leánya úszni voltak, öngyilkos lett. A sors szomorú játéka, hogy nem sokkal ezután Jean Perrin kísérletileg is bizonyította az atomok létezését és ennek hatására maga Ostwald is "megtért".
Kvantum-termodinamika
Az 1860-as években Bunsen és Kirchhoff együtt dolgoztak, és feltalálták a spektroszkópot. Kirchhoff felfedezte, hogy ha valamely anyag képes egy adott hullámhosszú fényt kibocsátani, akkor annak elnyelésére is képes. Sőt arra is rájött, hogy az elnyelő- és kibocsátóképesség (az abszorpció- és emisszióképesség) hányadosa egy adott hullámhosszon független az anyag minőségétől, csakis a hőmérséklettől függ. Adott hőmérsékleten és hullámhosszon, különböző testek esetében, ha E a sugárzás alakjában kibocsátott energia és ugyanazon a hőmérsékleten és hullámhosszon A a testre eső energia elnyelt hányada, akkor E1/A1=E2/A2=.... Kirchhoff vezette be az abszolút fekete test fogalmát. Abszolút fekete testen olyan testet értünk, amely minden ráeső sugárzó energiát teljes mértékben elnyel, tehát abszorpcióképessége egységnyi: A=1. Eszerint E1/A1=E2/A2=Efekete/1=Efekete. Azaz bármely test emisszióképességének és abszorpcióképességének hányadosa egyenlő az abszolút fekete test emisszióképességével. Planck az abszolút fekete test sugárzásán gondolkodva jött rá az energia kvantáltságára.
Robert Wilhelm Eberhard Bunsen (1811-1899)
 Göttingenben született, ahol apja a modern nyelvek professzora volt. Ugyanott doktorált 1830-ban fizikából. 1830 és 1833 között sokat utazott Európában. Neves tudósokkal találkozott, többek között Liebiggel és Gay-Lussackal. Több német egyetemen tanított, Kasselban Wöhler utóda volt. 1852-től 1889-ig (78 éves koráig!) a heidelbergi egyetem professzora. Lelkiismeretes, kiváló tanár volt. Nem egy diákjából híres tudós lett. Egyetemi előadásai intuitívek voltak és a tapasztalaton alapultak. Az elméletek nem érdekelték. Állítólag Avogadro hipotézisét meg sem említette hallgatóinak. A periódusos rendszerről sem szólt, pedig Mengyelejev és Meyer tanítványai voltak.
Göttingenben született, ahol apja a modern nyelvek professzora volt. Ugyanott doktorált 1830-ban fizikából. 1830 és 1833 között sokat utazott Európában. Neves tudósokkal találkozott, többek között Liebiggel és Gay-Lussackal. Több német egyetemen tanított, Kasselban Wöhler utóda volt. 1852-től 1889-ig (78 éves koráig!) a heidelbergi egyetem professzora. Lelkiismeretes, kiváló tanár volt. Nem egy diákjából híres tudós lett. Egyetemi előadásai intuitívek voltak és a tapasztalaton alapultak. Az elméletek nem érdekelték. Állítólag Avogadro hipotézisét meg sem említette hallgatóinak. A periódusos rendszerről sem szólt, pedig Mengyelejev és Meyer tanítványai voltak.
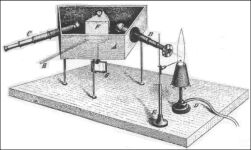
Bunsen és Kirchhoff spektroszkópja
Bunsen kezdetben szervetlen kémiával foglalkozott. Ezután áttért a szerves kémiára, de nem volt szerencséje. 1837 és 1843 között arzéntartalmú szerves vegyületekkel dolgozott és arzénmérgezést kapott. 1843-ban egy cianocsoportot tartalmazó szerves vegyület felrobbanása fél szeme világát követelte. Ezt követően főleg szervetlen és fizikai kémiával foglalkozott. A Bunsen-égőt minden kémikus ismeri. Érdekelte a geológia is, számos geológiai expedícióban vett részt, és ásványokat analizált.
Megszállott kutató volt, és mint olyan, szórakozott ember. Sohasem nősült meg. Állítólag egyszer megkérte egy fiatal hölgy kezét, aki igent is mondott. Bunsen ezután hazament, beletemetkezett a munkába és teljesen elfeledkezett a dologról. Egy évvel később újra megkérte ugyanannak a hölgynek a kezét, de ekkor már kikosarazták.
Gustav Robert Kirchhoff (1824-1887)
 Königsbergben született, ott is fejezte be tanulmányait. Berlinben halt meg. Huszonegy éves korában (!) állította fel az elektromos hálózatelmélet alapjául szolgáló Kirchhoff-törvényeket. 1854-ben Heidelbergben lett a fizika professzora, ott, ahol Bunsen is tanított. Együtt dolgoztak a spektroszkóp kifejlesztésén. Kirchhoff ötlete volt a prizma alkalmazása a fényfelbontásra. 1860-ban jelent meg első közös cikkük ebben a témában. Itt írta le Bunsen és Kirchhoff az emissziós atomspektroszkópia alaptörvényeit, amelyek alapján új kémiai elemek felfedezése vált lehetővé.
Ők fedezték fel a spektrumvonalak alapján a céziumot (latinul a caesius kékesszürkét jelent) és a rubídiumot, amely a spektrum vörös vonaláról kapta a nevét. Kirchhoff sokat foglalkozott a napszínkép felvételével is, de ezzel annyira tönkretette a szemét (spektroszkóp esetében vizuális érzékelésről van szó), hogy a munkát nem tudta befejezni. A napszínkép felvételét a magyar Hofmann Károly folytatta.
Königsbergben született, ott is fejezte be tanulmányait. Berlinben halt meg. Huszonegy éves korában (!) állította fel az elektromos hálózatelmélet alapjául szolgáló Kirchhoff-törvényeket. 1854-ben Heidelbergben lett a fizika professzora, ott, ahol Bunsen is tanított. Együtt dolgoztak a spektroszkóp kifejlesztésén. Kirchhoff ötlete volt a prizma alkalmazása a fényfelbontásra. 1860-ban jelent meg első közös cikkük ebben a témában. Itt írta le Bunsen és Kirchhoff az emissziós atomspektroszkópia alaptörvényeit, amelyek alapján új kémiai elemek felfedezése vált lehetővé.
Ők fedezték fel a spektrumvonalak alapján a céziumot (latinul a caesius kékesszürkét jelent) és a rubídiumot, amely a spektrum vörös vonaláról kapta a nevét. Kirchhoff sokat foglalkozott a napszínkép felvételével is, de ezzel annyira tönkretette a szemét (spektroszkóp esetében vizuális érzékelésről van szó), hogy a munkát nem tudta befejezni. A napszínkép felvételét a magyar Hofmann Károly folytatta.
Max Planck (1858-1947)
 Münchenben és Berlinben tanult fizikát. 1879-ben doktorált a termodinamika második főtételének témaköréből. München, majd Kiel után 1899-ben Berlinbe hívják Kirchhoff utódjául. Legnagyobb tudományos eredménye a feketetest-sugárzás formulájának levezetése az energia kvantáltságának feltételezésével (1900). "Einführung in die teoretische Physik" című ötkötetes műve (1916-1932) világszerte nagy hatást gyakorolt a tudósokra.
Münchenben és Berlinben tanult fizikát. 1879-ben doktorált a termodinamika második főtételének témaköréből. München, majd Kiel után 1899-ben Berlinbe hívják Kirchhoff utódjául. Legnagyobb tudományos eredménye a feketetest-sugárzás formulájának levezetése az energia kvantáltságának feltételezésével (1900). "Einführung in die teoretische Physik" című ötkötetes műve (1916-1932) világszerte nagy hatást gyakorolt a tudósokra.
Magánéletét tragédiák sora kísérte. Egyik fia még az első világháborúban elesett, ikerlányai korán meghaltak. Másik fiát egy Hitler elleni összeesküvésben való részvétel miatt kivégezték. A háború végén háza - felbecsülhetetlen tudománytörténeti értékekkel együtt - lángok martaléka lett. Önéletrajzának egyik megdöbbentő részlete: "Valamely új tudományos igazság nem úgy szokott győzelemre jutni, hogy az ellenfelek meggyőzetnek és kijelentik, hogy megtértek, hanem inkább úgy, hogy az ellenfelek lassanként kihalnak és a felnövekvő nemzedék már eleve hozzászokik az igazsághoz."
A kvantumelmélet 1900-as megszületése után évekig nem keltett érdeklődést. Maga Planck is kétkedő volt egészen addig, amíg Einstein meg nem győzte őt az elmélet helyességéről. A közömbösség oka talán abban keresendő, hogy az elmélet az abszolút fekete test sugárzásának leírására született és ez abban az időben kevéssé érdekelte a fizikusokat. A sugárzásokkal kapcsolatban túlságosan is sok volt az új felfedezés. 1895-ben fedezték fel a röntgensugárzást, 1896-ban a radioaktivitást, 1897-ben az elektront, 1898-ban a rádiumot. A kémikusok csak a Bohr-modell 1913-as megszületése után kezdtek kvantumokban gondolkodni. Jellemző, hogy Planck csak 1918-ban kapta meg felfedezéséért a Nobel-díjat, miután a Bohr-modell már sikeresen működött.
Talán Einstein volt az első, aki észrevette a kvantumelmélet jelentőségét. 1907-ben a kvantumelmélet alapján egyenletet vezetett le a kristályok hőkapacitásának számítására. Egy mólnyi részecskéből álló kristályt tekintett. A részecskéket egymástól független harmonikus oszcillátornak vette és feltételezte, hogy valamennyi ugyanazzal a ν frekvenciával rezeg. Az oszcillátorok energiája kvantált. Ezt a kvantumot a foton mintájára fononnak nevezzük (görögül a phonosz hangot jelent). Einstein felírta erre a kristályra a vibrációs állapotösszeget és abból vezette le híres fajhőfüggvényét. A fajhő nagy hőmérsékletű határértéke Einstein szerint 3R, ahol R a gázállandó. Két francia fizikus, Dulong és Petit már 1819-ben észrevette, hogy a szilárd kémiai elemek hőkapacitása közönséges hőmérsékleten (ebben a vonatkozásban a közönséges hőmérséklet nagy hőmérsékletnek számít) jó közelítéssel 3R. Ez a híres Dulong-Petit-szabály. Einstein tehát a kvantumelméletből származó fajhőfüggvény határértékeként klasszikus törvényhez jutott, ami fényesen igazolta a kvantumelmélet hatékonyságát a termodinamikában.
_________________________
Természet Világa 2006. június - Termodinamika